U většiny nedonošenců je postvakcinační imunita dostatečná, srovnatelná s odpovědí dětí donošených. Existují studie, které zvláště u extrémně nezralých dětí, po standardním očkování prokazují dílčí odchylky v kvalitě imunitní odpovědi. U nedonošenců byla prokázána snížená schopnost proliferace i diferenciace lymfocytů.
1. Východiska
U většiny nedonošenců je postvakcinační imunita dostatečná, srovnatelná s odpovědí dětí donošených.
Existují studie, které zvláště u extrémně nezralých dětí, po standardním očkování prokazují dílčí odchylky v kvalitě imunitní odpovědi. U nedonošenců byla prokázána snížená schopnost proliferace i diferenciace lymfocytů. Nedonošenci tak mají menší počet T lymfocytů (včetně Th lymfocytů) i menší počet B lymfocytů. Nedostatečná schopnost tvorby protilátek se tím promítá i do odpovědi na povrchové polysacharidové bakteriální antigeny, která je tak ještě horší, než je tomu u zralého kojence. Nedonošenec je rovněž méně vybaven pasivním přenosem mateřských protilátek izotypu IgG, protože významný podíl přenosu se odehrává až v posledním měsíci fyziologické gestace).
Nedonošenec se tak řadí mezi imunokopromitované jedince, kterým by naopak měla být věnována zvýšená pozornost, vakcinační podporu nevyjímaje. Analogii nacházíme u srovnatelně oslabených jedinců vyšších věkových skupin. Například riziko onemocnění pertussí, rotavirou enteritidou nebo riziko nákazy pneumokokem je u nedonošených více než dvojnásobné oproti zralým dětem. Případný neopodstatněný odklad vakcinace toto riziko pochopitelně ještě zvýší.
Je potřeba zdůraznit, že maturace jakékoli imunitní odpovědi (buněčné i protilátkové odpovědi včetně tvorby IgG podtříd) není u nedonošence paralyzována, je pouze snížená. Dostatečné ochranné odpovědi po antigenním stimulu (po vakcinaci) dosáhne téměř každé donošené dítě, dosáhne ji i téměř každý nedonošenec, byť s menší razancí a s menšími odchylkami. Převážná většina nedonošených dětí docílí dostatečnou imunoprotekci proti většině vakcinačních antigenů, v některých případech ovšem až po následných booster dávkách.
2. Zahájení očkování
Ve shodě s literárními údaji vakcinaci zahajujeme ve stejném věku jako v případě očkovacího schématu dětí donošených. To v našich podmínkách, ve shodě s řadou evropských států i s USA, znamená zahájení nejpozději v 9. týdnu kalendářního věku. Nedonošenost dítěte bez dalších komplikací, bez ohledu na porodní hmotnost i hmotnost v den očkování, není důvodem k odložení očkování.
Za důvod odkladu očkování by neměla být považována určitá imunologická nezralost nedonošence. Právě naopak je imunokompromitace mimo jiné důvodem vyššího rizika preventabilních infekcí včetně hemofilů, pneumokoků, pertusse a rotavirů. Z tohoto důvodu je třeba očkování zbytečně neodkládat, aby se vyšší riziko naturálních infekcí snížilo na minimum. Proočkovanost kontaktů (rodičů), jakkoli se jedná o racionální opatření, by neměla být považována za plnohodnotný postup pro ochranu jedince.
3. Odložení zahájení očkování
Zahájení očkování může být oprávněně odloženo z důvodů neimunologických. Přednostně je potřeba zohlednit neurologický stav dítěte (neurologický nález). Jednoznačných kontraindikací z této indikace je ve skutečnosti velmi málo. Jsou to v podstatě jen progresivní neurologická onemocnění. Přispělo k tomu snížení antigenního potenciálu v současnosti používaných vakcín (snížení antigenní zátěže užívání acelulární pertussové složky v hexavakcíně).
Pro zahájení či v samotném načasování jednotlivých termínů očkování se podle světového písemnictví nezohledňuje věk přepočítávaný, resp. korigovaný, jak tomu v ČR často bývá.
Nejčastější situace, u nichž přichází v úvahu odklad zahájení očkování s uvedením stanoviska
ČSAKI:
- delší hospitalizace po narození. Stanovisko: očkování by se mělo zahajovat - s výjimkou rotavirů - již v
- neurologické postižení. Stanovisko: Kontraindikací očkování je ve skutečnosti velmi málo. Rozhoduje o ní neurolog ve spolupráci s lékařem specializovaného
- kardiovaskulární onemocnění Stanovisko: mělo by tomu být právě naopak, tedy očkovat co nejdříve.
- bronchopulmonální dysplazie. Stanovisko: mělo by tomu být právě naopak, tedy očkovat co nejdříve.
- pochybnosti o bezpečnosti. Stanovisko: nemá oporu v
- pochybnosti o účinnosti. Stanovisko: nemá oporu v
- pochybnosti o dávce. Stanovisko: dbát na booster dávky.
- individuální důvody s ohledem na aktuální zdravotní stav
4. Nežádoucí účinky
Nežádoucí účinky vakcín u nedonošených jsou srovnatelné s NÚ u dětí donošených.
Výjimkou je možnost kardiorespirační instability, uváděná ale pouze v některých studiích. To se týká pouze očkování první hexavakcínou či pentavakcínou (bez hepatitidy B, v ČR není k dispozici). Popisované jsou apnoe a bradykardie, a to přednostně u extrémně nezralých dětí pod 32. týden, při očkování do 60. dne kalendářního věku a u hmotnosti v den očkování pod 2000 g. Prevalence těchto NÚ je něco málo přes 10 %, objevují se výhradně v prvních 72 hodinách. Pro prevenci, resp. pro observaci a případnou léčbu těchto příhod se doporučuje zahájit očkování dětí ještě při pobytu v nemocnici. Ostatně dlouhá hospitalizace u extrémně nezralých dětí není nic neobvyklého.
5. Poznámky k jednotlivým vakcínám
5.1 hexavakcína (DTaP, HBV, IPV, Hib)
Hexavakcína je základním schématem mnoha mezinárodních i národních doporučujících postupů vakcinace, a to i v případě nedonošenců, včetně nedonošenců pod 1500 g porodní hmotnosti. V řadě případů jde o zahajovací vakcínu, pokud nepředchází očkování rotavirovou vakcínou. V některých zemích se používá pentavakcína (bez hepatitidy B, HBV) a to z důvodů individuálního očkování HBV již od narození (důvod epidemiologický).
V současnosti doporučované použití tetravakcíny postrádá dostatečné EBM zdroje z ekonomicky vyspělých zemí. Ukazuje se, že preference tetravakcíny před hexavakcínou je více či méně české popř. slovenské specifikum. Argumentem pro tento postup je vyšší reaktogennost antigenů vakcín dětské obrny a hepatitidy B. Nicméně některé nedávné studie s hexavakcínou tuto obavu nepotvrzují, prokazují naopak srovnatelnou toleranci (např. Bar-On, Esposito, Faldella, Vázquez aj.) s dobrou imunoprotekcí (imunogenicitou) i u nedonošených dětí.
U hexavakcíny se připouští simultánní podání s vakcínou pneumokokovou, ale i s rotavirovou vakcínou a to opět i u nedonošenců.
5.2. rotaviry
Nedonošenec je několikanásobně více ohrožen rotavirovou gastroenteritidou. Rotavirová vakcína je oslabená (atenuovaná) živá vakcína s poměrně nízkými riziky po podání.
Z epidemiologického hlediska jí ale nelze aplikovat na JIP ani na standardním lůžkovém dětském oddělení. Ve světě se nedonošencům konsenzuálně doporučuje již od 6. týdne věku, a to dokonce bez ohledu na gestační věk. Rizika NÚ opět nejsou větší, než u dětí donošených. Zásadní kontraindikací je pouze předchozí invaginace.
Z imunologického hlediska je kontraindikací použití této živé očkovací látky podezření či přítomnost těžkého kombinovaného imunodeficitu (SCID).
5.3. RSV
Někteří rizikoví nedonošenci, zvláště s hmotností pod 1500 g, přednostně s přítomností chronického plicního postižení (bronchopulmonální dysplazie), mohou být v období od listopadu do března pasívně imunizováni monoklonální protilátkou palivizumab za účelem ochrany před velmi rizikovou RS virovou infekcí (preparát Synagis®). Vzhledem k charakteru preparátu by nemělo docházet k nežádoucím imunologickým interakcím, proto se jednotlivé aplikace (1x měsíčně i.m.) nemusí nijak synchronizovat s jinou imunointervencí. Aplikace palivizumabu je omezena na specializovaná perinatologická centra.
6. Literatura
- American Academy of Pediatrics. Immunization in special clinical circumstances. In: Pickering LK, editor. 2003 Red Book. Report of the Committee on Infectious Diseases. 26th ed. Elk Grove Village: American Academy of Pediatrics; 2003. p. 54-81.
- Bar-On ES, Goldberg E, Hellmann S, Leibovici L. Combined DTP-HBV-HIB vaccine versus separately administered DTP-HBV and HIB vaccines for primary prevention of diphtheria, tetanus, pertussis, hepatitis B and Haemophilus influenzae B (HIB). Cochrane Database Syst Rev. 2012
- Baxter D. Impaired functioning of immune defenses to infection in premature and term infants and their implications for vaccination. Hum Vaccin. 2010;6(6):494-
- Baxter D et al. Vaccinating premature infants in a Special Care Baby Unit in the UK: results of a prospective, non-inferiority based, pragmatic case series study. Hum Vaccin. 2010;6(6): 512-20.
- Bonhoeffer J, Siegrist CA, Heath PT. Immunisation of premature infants. Arch Dis Child 2006;91:929-935
- Carbone T, McEntire B, Kissin D, Kelly D, Steinschneider A, Violaris K, et al. Absence of an increase in cardiorespiratory events after diphtheria-tetanus-acellular pertussis immunization in preterm infants: A randomized, multicenter study. Pediatrics. 2008;121(5):e1085-e90.
- Centers for Disease Control and Prevention. General recommendations on immunization: Recommendations of the Advisory Committee on Immunization. Practices (ACIP). MMWR Recomm Rep. 2011;60(RR-02):1-61. http://www.cdc.gov/vaccines/acip/.
- Clifford V, Crawford NW, Royle J, Lazzaro T, Danchin M, Perrett KP, et al. Recurrent apnoea post immunisation: Informing re-immunisation policy. 2011;29(34):5681-7.
- Committee on Infectious Diseases, American Academy of Pediatrics. Policy statement: Recommendations for prevention and control of influenza in children, 2011–2012. Pediatrics. 2011;128(4).
- Crawford NW, Bines JE, Royle J, Buttery JP. Optimizing immunization in pediatric special risk groups. Expert Rev Vaccines. 2011;10(2):175-86.
- Crawford NW, Buttery JP. Preterm infants immunization. J Paediatr Child Health. 2010;20(6):297-301.
- D'Angio CT. Active immunization of premature and low birth-weight infants: a review of immunogenicity, efficacy, and tolerability. Paediatr Drugs. 2007; 9(1):17-32.
- D’Angio CT, Heyne RJ, O’Shea TM, Schelonka RL, Shankaran S, Duara S, et al. Heptavalent pneumococcal conjugate vaccine immunogenicity in very-low- birth-weight, premature Pediatr Infect Dis J. 2010;29(7):600-6.
- D'Angio CT, Heyne RJ, Duara S, Holmes LC, O'Shea TM, Wang H, Wang D, Sánchez PJ, Welliver RC, Ryan RM, Schnabel KC, Hall CB; Premature Infant Vaccine Collaborative. Immunogenicity of trivalent influenza vaccine in extremely low-birth-weight, premature versus term infants. Pediatr Infect Dis J. 2011 Jul;30(7):570-4
- Esposito S, Fumagalli M, Principi N. Immunogenicity, safety and tolerability of vaccinations in premature infants. Expert Rev Vaccines . 2012 Oct;11(10):1199-209
- Esposito S, Serra D, Gualtieri L, Cesati L, Principi N. Vaccines and preterm neonates: Why, when, and with what. Early Hum Dev. 2009;85(Suppl 10):S43-5.
- Faldella G, Galletti S, Corvaglia L, Ancora G, Alessandroni R Safety of DTaP-IPV-HIb-HBV hexavalent vaccine in very premature infants. Vaccine. 2007 Jan 22; 25(6):1036-42.
- Flatz-Jequier A, Posfay-Barbe KM, Pfister RE, Siegrist C-A. Recurrence of cardiorespiratory events following repeat DTaP-based combined immunization in very low birth weight premature infants. J Pediatr. 2008;153(3):429-31.
- Furck AK, Richter JW, Kattner E. Very low birth weight infants have only few adverse events after timely immunization. J Perinatol. 2010;30(2):118-21.
- Gad A, Shah S. Special immunization considerations of the preterm infant. J Pediatr Health Care. 2007;21(6):385-91.
- Healy CM. Immunization strategies to protect preterm infants. Neoreviews. 2010;11(8):e409-18.
- Immunisation for the low birth weight and/or preterm infant. http://www.immune.org.nz/sites/default/files/resources/AdministrationPretermLowBirthWgtImac20120508V04Final.pdf
- Klein NP, Massolo ML, Greene J, Dekker CL, Black S, Escobar GJ, et al. Risk factors for developing apnea after immunization in the Neonatal Intensive Care Unit. Pediatrics. 2008;121(3):463-9.
- Ministry of Health. Immunisation handbook 2011. Wellington: Ministry of Health;
- Moss SJ, Fenton AC, Toomey JA, Grainger AJ, Smith J, Gennery AR. Responses to a conjugate pneumococcal vaccine in preterm infants immunized at 2, 3, and 4 months of age. Clin Vaccine Immunol. 2010;17(11):1810-6.
- Saari TN et al. Immunization of preterm and low birth weight infants. American Academy of Pediatrics Committee on Infectious Diseases. Pediatrics, 2003, 112:193-198.
- Omeñaca F, et al. Response of Preterm Newborns to Immunization With a Hexavalent Diphtheria–Tetanus–Acellular Pertussis–Hepatitis B Virus–Inactivated Polio and Haemophilus influenzae Type b Vaccine: First Experiences and Solutions to a Serious and Sensitive Issue. Pediatrics 2005; 116: 1292–1298 http://pediatrics.aappublications.org/content/116/6/1292.full
- Omeñaca F, Garcia-Sicilia J, Boceta R, García-Corbeira P. Hepatitis B response of premature infants after primary and booster immunisation with a diphtheria- tetanus-acellular pertussis- hepatitis B-inactivated poliovirus/Haemophilus influenzae type b vaccine. Infect Dis Obstet Gynecol. 2010;2010:1.
- Omeñaca F, Merino JM, Tejedor J-C, Constantopoulos A, Papaevangelou V, Kafetzis D, et Immunization of preterm infants with 10-valent pneumococcal conjugate vaccine. Pediatrics. 2011;128(2):e290-8.
- Ruckinger S, van der Linden M, von Kries R. Effect of heptavalent pneumococcal conjugate vaccination on invasive pneumococcal disease in preterm born infants. BMC Infect Dis. 2010;10(1):12.
- van den Berg JP, Westerbeek EAM, van der Klis FRM, Berbers GAM, van Elburg RM. Transplacental transport of IgG antibodies to preterm infants: A review of the literature. Hum Vaccin. 2011;87(2):67-72.
- Vázquez L, Garcia F, Rüttimann R, Coconier G, Jacquet J-M, Schuerman L. Immunogenicity and reactogenicity of DTPa-HBV-IPV/Hib vaccine as primary and booster vaccination in low- birth-weight premature infants. Acta Paediatr. 2008;97(9):1243-9.
- Ygberg S, Nilsson A. The developing immune system – from foetus to toddler. Acta 2012;101(2):120-7.
Stanovisko vypracoval:
MUDr. Martin Fuchs a kolektiv členů výboru České společnosti alergologie a klinické imunologie
ČLS JEP.
Stanovisko bylo schváleno na schůzi výboru České společnosti alergologie a klinické imunologie
ČLS JEP.dne 13. března 2014.
Vysvětlivky zkratek
| ČSAKI | Česká společnost alergologie a klinické imunologie ČLS JEP |
| EBM | medicína založená na důkazech (Evidence based medicine) |
| DTaP | diftérie, tetanus a perstusse |
| HBV | virus hepatitidy B |
| IPV | inaktivovaná vakcína proti poliu |
| HiB | Haemophilus inflenzae skupiny B |
| RSV | Respiratory syncytial virus |
Příloha stanoviska ČSAKI ČLS JEP ka problematice očkování dětí sa nízkou porodní hmotností (<1500 g)
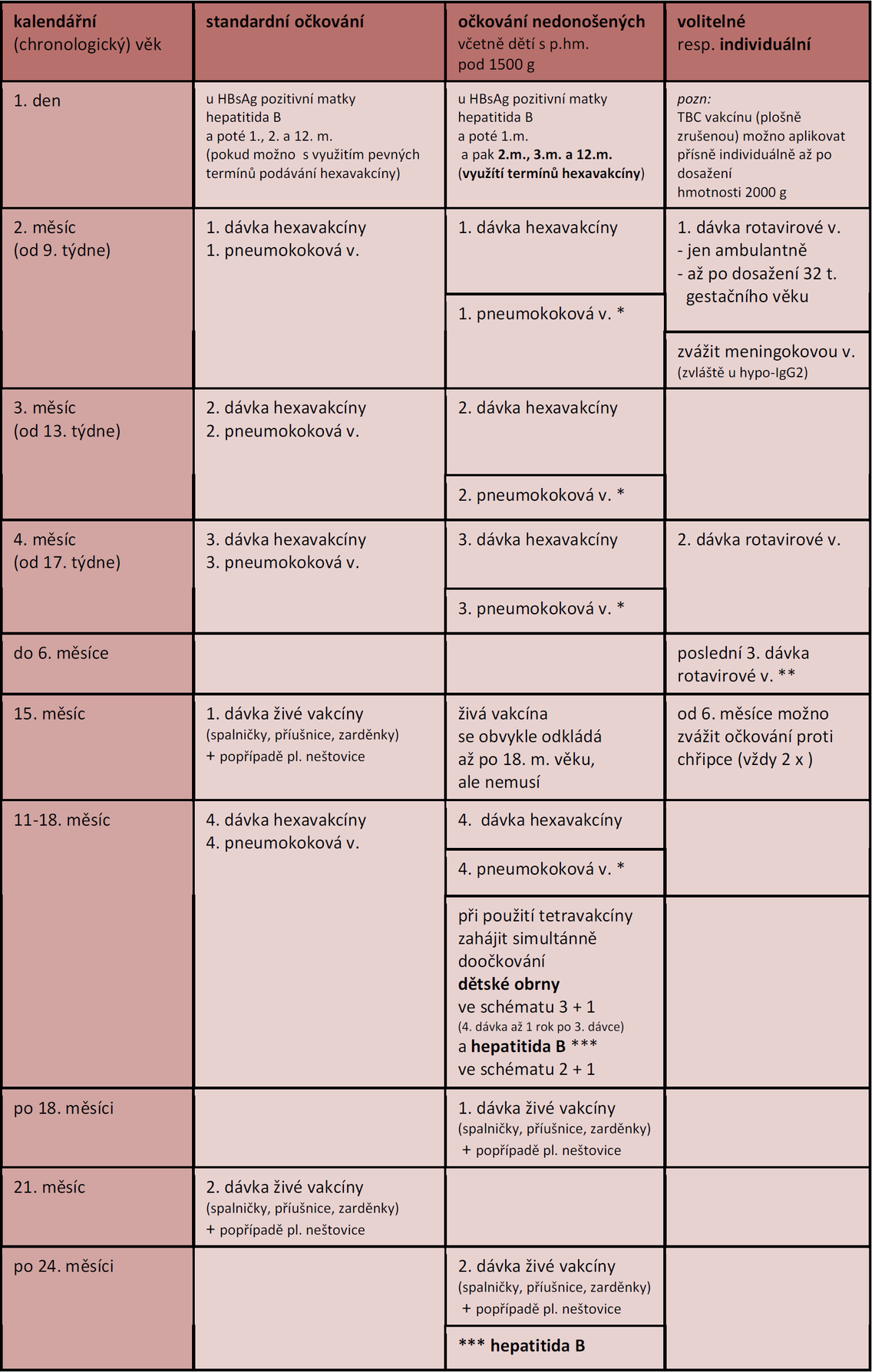
| hexavakcína: | Infanrix hexa záškrt, tetanus, dávivý kašel, hemofilusa b (influenzae), dětská obrna, hepatitida Boptimálně ještě předa propuštěním za nemocnice (observace apnoických pauz) |
| pneumokokové v.: | konjugované vakcíny Prevenar, Synflorix * obvykle 14a dní poa hexa čia tetra vakcíně, va individuálních případech (např.a va nemocnici možno ia simultánně) |
| živá vakcína: | Priorix, Priorix-tetra (sa pl. neštovicemi), Varilrix (samotné pl. neštovice |
| rotavirové v.: | živé vakcíny RotaTeq (3x **), Rotarix (2x) |
| dětská obrna: | inaktivovaná vakcína Imovax polio |
| hepatitida B: | Engerix-Ba 10a μg (stejné množství v hexavakcín) nicméně některá doporučení datují doočkování hep. Ba aža poa 24a m. věku ***, a to pravděpodobně pro vyšší reaktogennost (resp. reaktogenicitu) |
| chřipka: | subjednotková trivalentní vakcína Influvac nebo štěpená trivalentní vakcína, např. Vaxigrip aplikace poloviční dávky (tj. 0,25 ml) aa podat 2a x, va intervalu minim. 1a m., přednostně ua nedonošenců sa chr. plicním onem. (bronchopulmonální dysplazie |